2018年1月26日,中国科协生命科学学会联合体公布了2017年中国生命科学十大进展,昆明理工大学季维智院士团队与同济大学孙毅教授合作的“中国学者首次建立基因编辑瑞特综合征猴模型”研究成果入选。2018年8月4日,2017年度中国生命科学十大进展交流会暨青少年科普报告会在南京江北新区成功举行。季维智院士、陈永昌教授参加了颁奖仪式。

饶子和院士、江苏省领导为获奖者颁奖
随后,陈永昌教授与其他9位获奖代表分别做了科普报告。南京中华中学、外国语学校、南师附中、金陵中学河西分校、南京九中的500多位初中生、高中生聆听了报告并提出了一系列非常有趣、“博士级别”的尖锐问题。中国科学院院士饶子和、程和平、邵峰、季维智,中国科协、江苏省及南京市相关领导参加了整个活动过程。
季维智团队的获奖项目介绍
靶向基因编辑建立瑞特综合征食蟹猴模型
陈永昌1 孙毅2 季维智1
- 昆明理工大学灵长类转化医学研究院,昆明 650500
- 同济大学医学院干细胞研究中心,上海 200092
自闭症(autism)是一个医学名词,最早由美国医生Kanner命名[1],又称孤独症,是一种由于神经系统发育失调导致的精神疾病,临床症状主要表现为不正常的社交及沟通能力、语言表达障碍、异常的兴趣和行为模式。由于病症非常复杂,学术上一般更多地使用自闭症谱系障碍(autism spectrum disorder,ASD),是一类广泛性的神经系统发育性疾病[2],包括瑞特综合征(Rett syndrome,RTT),阿斯伯格综合症(Asperger syndrome),童年瓦解性障碍(Childhood disintegrative disorder,CDD)等(图1)。
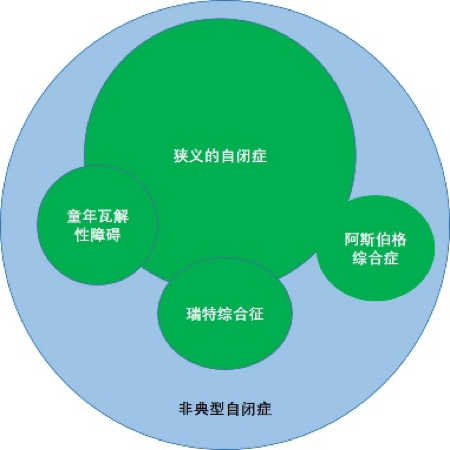
图1. 自闭症谱系障碍图解。
电影《雨人》的上映使得媒体及公众对自闭症及其他罕见病的关注度进一步提升。2007年12月联合国大会通过决议,从2008年起,将每年的4月2日定为“世界自闭症关注日”,以提高人们对自闭症和相关研究与诊断以及自闭症患者的关注;2008年2月29日,欧洲罕见病组织(EURORDIS)发起了第一届国际罕见病日,随后国际上将每年2月份的最后一天定为“国际罕见病日”。全球发病率调查显示,ASD的发病率呈现不断升高的趋势,在一些地区已高达1/68[3,4],发达国家ASD的发病率显著高于发展中国家,如美国、日本和欧洲的发病率要显著高于其他地区[4,5],这可能与社会对ASD的关注度有关。调查还显示发病率还与父母的生育年龄、教育程度等成正比,一般受教育程度越高,母亲的年龄越大,可能大龄母亲的卵质量、身体素质等有所下降,导致的早产、胎儿发育不良等情况较多[6,7]。
大部分ASD患者的病因还不明确,一般认为与环境及遗传因素都有关系。已发现同卵双胞胎中的一个患病,另一个患病的概率为60-70%;异卵双生的概率可达30%,非双生同胞患病的相关性为18%[8,9]。这说明遗传因素是导致ASD的重要因素。目前已发现多个与自闭症发病相关的基因,如与神经元突触连接及细胞黏附相关的FMR1,NLGN3/4,NRXN1,SHANK3,CNTNAP2等,与神经元活性相关的MECP2,UBE3A等[10]。由于临床诊断上首先会根据患者的病症来判断,而许多神经系统疾病会有一些共同的表现,因此在确诊某一种疾病时,通常会制定一系列的诊断标准,如必须标准、支持标注、排除标准等[11]。即便如此,仅凭临床症状还是很难确诊某一种疾病。近年来发展起来的基因测序技术为筛选致病基因做出了重大贡献,也使得疾病的诊断更为准确,这将有助于筛查ASD的致病基因。
临床上ASD患者以男孩较为常见,而瑞特综合征(Rett Syndrome, RTT)则以女孩患者为主。现已知道,RTT是属于ASD的一种神经发育性疾病,通常导致男性胎儿在胚胎期流产,而患病的女孩在出生后6-18个月开始表现语言能力丧失、睡眠质量差、社交和认知障碍、大脑发育变缓、心电图异常、运动能力异常等综合症状。该病最早是1966年由奥地利医生Andreas Rett首先报道的[12],当时只报道了1例女性患者。1983年,Bengt Hagberg等报道了35例类似患者,较为系统地对发病过程及临床症状进行了描述,并以发现者的名字命名为Rett Syndrome[13]。随后的研究者对该疾病进行了较为全面的研究和跟踪,根据疾病的发病进程及严重程度进行了分级,包括早期停滞期、快速倒退期、假性稳定期、运动恶化晚期等[14]。1999年确定RTT是由遗传因素引起的神经发育性疾病。Huda Zoghbi等利用系统的基因筛查方法,发现MECP2基因突变缺失是导致RTT的直接原因[15]。其实早在1992年Adrian Bird团队就发现了MECP2基因,初步发现其主要参与甲基化调控过程[16]。致病基因的发现促进了实验动物模型的建立,2001年Huda Zoghbi和Adrian Bird实验室同时报道了Mecp2基因敲除的小鼠模型[17-18]。但是即便是Mecp2基因全敲的雄性小鼠也并不致死,直至6-9个月才出现后肢痉挛等轻微的神经症状,而雌性小鼠模型基本无症状。显然,小鼠模型与RTT患者男性胚胎期流产现象相悖,也不能开展高级认知功能及社交行为等测试,难以利用小鼠模型开展RTT疾病机理及治疗的研究。这也许是由于小鼠和人类的进化差异导致的。人类的大脑高度发达,不仅具有复杂的沟回以及大脑分区,体积也比小鼠大脑大得多。而非人灵长类,如猕猴及食蟹猴与人类有非常相似的遗传背景及生理特点,而且神经系统也最为接近,都具有发达的前额叶,控制着情绪、高级认知等复杂社会行为,是公认的研究人类发育及疾病、尤其是神经系统疾病最理想的动物模型。
基因编辑技术(TALENs,CRISPR/Cas9等)为建立灵长类RTT模型开启了新的大门。我们利用CRISPR/Cas9技术首次实现了对灵长类基因组的改造[19],同时也利用TALENs系统实现了猕猴及食蟹猴的基因编辑[20]。我们选择MECP2作为靶基因,当时发现所有怀孕的雄性胎猴均在胚胎期流产,仅有1只雌性猴出生[20]。这一现象也提示可能猴模型能模拟人类患者男性致死的情况,因此我们接着做了更多的猴模型。设计的基因编辑策略是用3对TALENs质粒对MECP2基因的3号外显子进行多点切割,并将TALENs与促进DNA修复的RAD51一起注射到1细胞期胚胎, 结果发现在细胞及早期胚胎中的编辑效率比较好,因此继续做了胚胎移植,最终获得5只存活雌性食蟹猴和2只雄性食蟹猴,其余胎儿在胚胎期流产。基因测序分析发现所有存活的雌性猴均实现了基因打靶,而存活的2只雄性猴并没有实现基因编辑,对胎儿组织的分析发现,所有被打靶的雄性胎儿均在胚胎期流产(图2,A-B)。这些结果首先证明我们已经获得一批经TALENs介导的MECP2基因敲除食蟹猴,雄性致死的情况也与人类患者相符合[20,21]。对流产猴脑组织的蛋白表达分析也发现基因敲除导致MeCP2蛋白表达量显著降低[21](图2,C)。
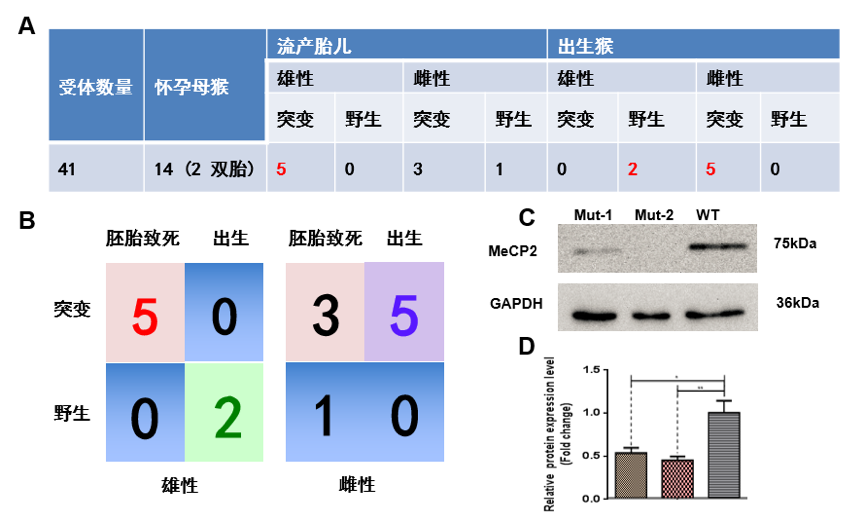
图2. TALENs介导的基因修饰猴模型。(A,B)基因编辑胚胎移植后的胎儿发育、出生及性别分布情况;(C,D)突变型(Mut)和野生型(WT)流产胎猴大脑皮层MeCP2蛋白的表达情况。
上述遗传学分析已证明我们获得了MECP2基因敲除的食蟹猴。为了证明这些动物是否为可以模拟临床患者的RTT猴模型,我们开展了一系列的行为表型分析,包括睡眠节律、社交行为、对外界刺激反应的敏感程度等,发现MECP2敲除食蟹猴与正常猴相比存在显著的差异,并和临床患者的症状类似。与小鼠模型相比较,RTT猴在更多的方面与临床患者更为接近,说明这些MECP2基因敲除的食蟹猴是真正的RTT猴模型(表1)。
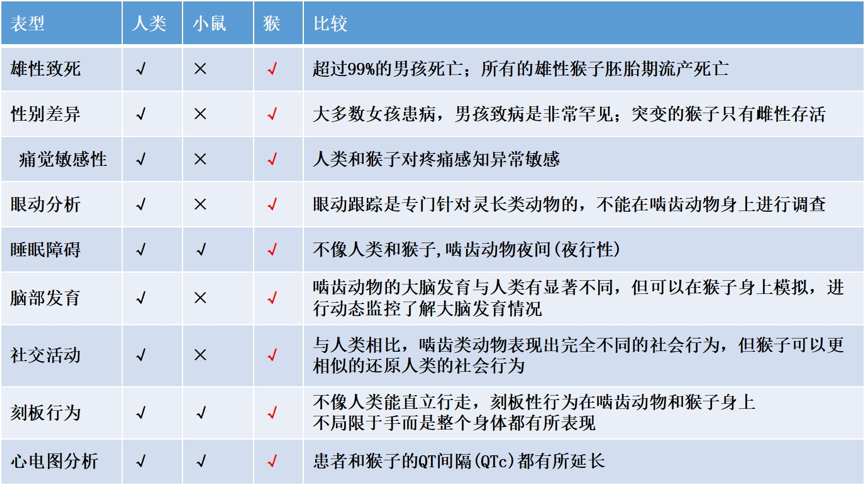
表1. RTT猴模型与小鼠模型行为学表型及与临床患者的比较
猴模型的优势还在于可以对其进行一些在小鼠上无法开展的测试,比如高级认知功能、情绪及社交行为、脑发育的动态监测等。通过MRI扫描对RTT猴脑结构动态变化情况的分析发现:许多脑区均发生了表面积、厚度及体积的变化(图3),并与已报道的临床病人的一些变化类似。而临床患者的检测是散点状态的,尚没有系统性、定期监测的动态变化数据。而小鼠因脑结构简单且发育速度较快,难以模拟患者情况。因此基于RTT猴模型的这些数据对于深入理解MECP2基因在灵长类大脑中的功能具有重要的参考价值。
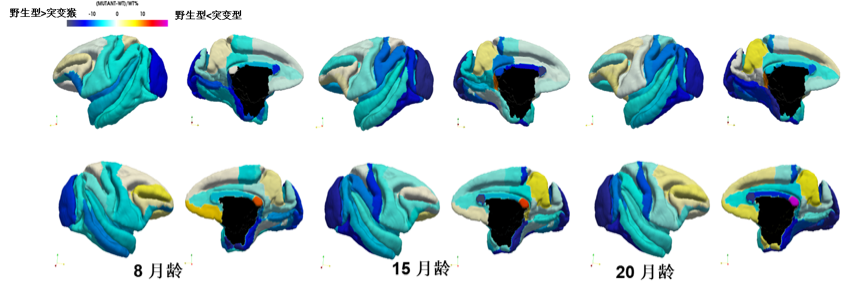
图3. MRI监测RTT猴模型脑结构动态变化情况(8月龄,15月龄及20月龄)。与野生型对照相比,暖色调表示模型的脑区体积变大,冷色调则表示变小。
眼动行为是灵长类动物区别于其他哺乳动物所特有的一种行为,RTT患者与狭义的自闭症患者不同,在发病的后期会出现主动的眼神交流,这也是自闭症与RTT的区别之一。对RTT猴模型的眼动数据采集发现,RTT猴模型更倾向于关注不带情绪的面孔,而当其眼前出现猴面孔及其他物体时,对面孔的关注要更多一些(图4)。这与临床患者的情况非常类似。
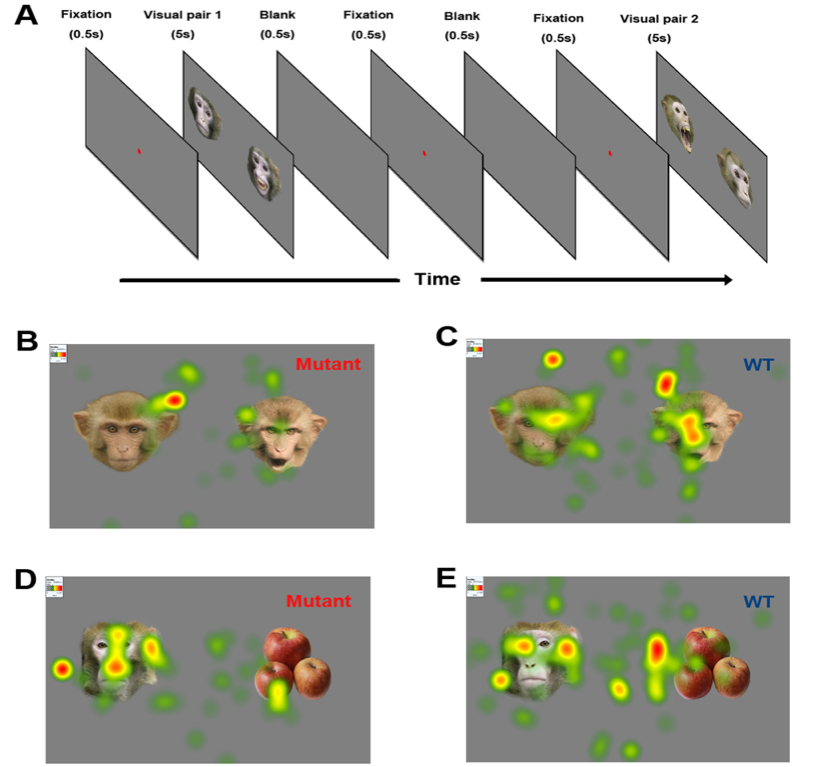
图4 眼动分析。(A)实验设计:以不同情绪的猴面孔图谱和食物作为参照,采用两点矫正,采集猴模型对感兴趣事物的关注度;(B,C)比较模型猴及对照动物对不同情绪面孔的关注情况;(D,E)比较模型猴及对照动物对猴面孔及其他物品的关注情况。
上述是我们自2012年底开始启动的通过敲除MECP2基因构建瑞特综合征猴模型的工作,相关结果于2017年5月18日发表在国际顶级生物学期刊Cell[21]上。获得的RTT猴模型很好地模拟人类患者,具有领先于其他动物同类模型的巨大优势,对RTT发病机制和治疗方法将发挥重要作用。
参考文献
[1] Kanner L: Child psychiatry - Mental deficiency. American Journal of Psychiatry 1943, 99:608-610.
[2] Caronna EB, Milunsky JM, Tager-Flusberg H: Autism spectrum disorders: clinical and research frontiers. Archives of Disease in Childhood 2008, 93:518-523.
[3] Wing L, Potter D. The epidemiology of autistic spectrum disorders: is the prevalence rising? Ment Retard Dev Disabil Res Rev. 2002;8(3):151-61.
[4] Wingate M, Kirby RS, Pettygrove S, Cunniff C, et al. Prevalence of autism spectrum disorder among children aged 8 years - autism and developmental disabilities monitoring network, 11 sites, United States, 2010. MMWR Surveill Summ. 2014 Mar 28;63(2):1-21.
[5] Feng L, Li C, Chiu H, Lee TS, et al. Autism spectrum disorder in Chinese populations: a brief review. Asia Pac Psychiatry. 2013 Jun;5(2):54-60.
[6] Mohammed HS, Wahass SH, Mahmoud AA. Incidence of autism in high risk neonatal follow up. Neurosciences (Riyadh). 2016 Jan;21(1):43-6.
[7] Atladóttir HÓ, Schendel DE, Henriksen TB, Hjort L, Parner ET. Gestational Age and Autism Spectrum Disorder: Trends in Risk Over Time. Autism Res. 2016 Feb;9(2):224-31.
[8] Hallmayer J, Cleveland S, Torres A, Phillips J, et al. Genetic heritability and shared environmental factors among twin pairs with autism. Archives of General Psychiatry, 2011, 68(11):1095-102.
[9] Hallmayer J, Glasson EJ, Bower C, Petterson B, et al. On the twin risk in autism. American Journal of Human Genetics, 2002, 71(4):941.
[10] Sutcliffe J S. Insights into the Pathogenesis of Autism. Science, 2008, 321(5886):208-209.
[11] American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders-5th Edition DSM-5TM. 2013.
[12] Rett A. [On a unusual brain atrophy syndrome in hyperammonemia in childhood]. Wiener Medizinische Wochenschrift, 1966, 116(37):723.
[13] Hagberg B, Aicardi J, Dias K, Ramos O. A progressive syndrome of autism, dementia, ataxia, and loss of purposeful hand use in girls: Rett's syndrome: report of 35 cases. Ann Neurol. 1983 Oct;14(4):471-9.
[14] Glaze DG. Rett syndrome: of girls and mice--lessons for regression in autism. Ment Retard Dev Disabil Res Rev. 2004;10(2):154-8.
[15] Amir RE, Van den Veyver IB, Wan M, Tran CQ, et al. Rett syndrome is caused by mutations in X-linked MECP2, encoding methyl-CpG-binding protein 2. Nature Genetics, 1999, 23(2):185-188.
[16] Lewis JD, Meehan RR, Henzel WJ, Maurer-Fogy I, et al. Purification, sequence, and cellular localization of a novel chromosomal protein that binds to methylated DNA. Cell. 1992 Jun 12;69(6):905-14.
[17] Guy J, Hendrich B, Holmes M, Martin JE, Bird A. A mouse Mecp2-null mutation causes neurological symptoms that mimic Rett syndrome. Nat Genet. 2001 Mar;27(3):322-6.
[18] Chen RZ, Akbarian S, Tudor M, Jaenisch R. Deficiency of methyl-CpG binding protein-2 in CNS neurons results in a Rett-like phenotype in mice. Nat Genet. 2001 Mar;27(3):327-31.
[19] Niu Y, Shen B, Cui Y, Chen Y, et al. Generation of gene-modified cynomolgus monkey via Cas9/RNA-mediated gene targeting in one-cell embryos. Cell 156, 836-843 (2014).
[20] Liu H, Chen Y, Niu Y, Zhang K, et al. TALEN mediated gene mutagenesis in rhesus and cynomolgus monkeys. Cell Stem Cell 2014; 14(3): 323-8.
[21] Chen Y, Yu J, Niu Y, Qin D, et al. Modeling Rett syndrome using TALEN-edited MECP2 mutant cynomolgus monkeys. Cell, 2017, 169(5):945.
(注:本文已被中国科协技术出版社出版,仅限科普用)
附:2017年度“中国生命科学领域十大进展”名单
1、“水稻新型广谱抗病遗传基础发现与机制解析”(四川农业大学陈学伟团队)
2、“人 Piwi 基因突变致男性不育”(中国科学院生物化学与细胞生物学研究所刘默芳团队)
3、“m6A 甲基化修饰调控脊椎动物造血干细胞命运决定”(中国科学院动物研究所刘峰团队)
4、“化疗药物通过 caspase-3 诱导细胞焦亡而产生毒副作用”(北京生命科学研究院邵峰团队)
5、“细胞感应葡萄糖水平并调控代谢的分子机制”(厦门大学林圣彩团队)
6、“基于单细胞测序的肝癌免疫图谱”(北京大学张泽民团队)
7、“水稻广谱持久抗病与产量平衡的遗传与表观调控机制”(中国科学院上海生命科学研究院何祖华团队)
8、“超高时空分辨微型化双光子在体显微成像系统”(北京大学程和平团队)
9、“痒觉信息处理的环路机制”(中国科学院神经科学研究所孙衍刚团队)
10、“中国学者首次建立基因编辑瑞特综合征猴模型”(昆明理工大学季维智团队)
